9,450,000 ریال
9,450,000 ریال
14,175,150 ریال
11,025,000 ریال
DNA Ladders And Protein Size Markers
Kiagene Ladder
لدر ها چه هستند از چه جنسی هستند و چه کاربردهایی دارند ؟یک “لدر” هم به عنوان یک کنترل و هم به عنوان ابزاری برای اندازه گیری وزن ماکرومولکولهایی مانند DNA عمل می کند. لدر محلولی است که شامل یک سری قطعاتDNA یا پروتئین با طولهای خاص میباشد. برخی از لدرها ممکن است حاوی قطعات DNA با اندازههایی مانند 50 جفت باز تا 10000 جفت باز (10 kbp) باشند یا پروتئین هایی در سایز های متفاوت را شامل شوند.
یکی از ابزارهایی که اغلب در بیولوژی مولکولی استفاده می شود، ژل الکتروفورز میباشد. با استفاده از ژل الکتروفورز، مولکولهای بزرگی مانند DNA، RNA یا پروتئین را میتوان بر روی ژل آگارز یا آکریل آمید که توسط جریان الکتریکی هدایت میشوند، از یکدیگر جدا کرد. لدرها را گاهی “نشانگر اندازه وزن مولکولی” نیز مینامند.
به طور معمول، یک نمونه کوچک از ماده ژنتیکی در فرورفتگی کوچک بالای ژل که چاهک نامیده میشود، بارگذاری میگردد. بارگذاری یک لدر یا یک نشانگر در یکی از چاه ها مهم است.
لدر مناسب برای استفاده بستگی به وزن مولکولی هدف مورد مطالعه دارد. می توان از یک لدر برای شناسایی تعداد تقریبی جفت باز در باند مورد نظر استفاده کرد.
علاوه بر اندازه گیری طول جفت باز، لدر ها هدف دیگری نیز دارند. اگر ژل ها به درستی ریخته نشده باشند، ممکن است تفاوت هایی در ضخامت ژل در عرض ژل وجود داشته باشد. این مشکل ممکن است در ژل های بزرگتر اتفاق بیفتد. اگر چنین باشد، DNA ممکن است با سرعت مد نظر در ژل الکتروفورز جریان پیدا نکند. حرکت یک لدر در هر دو انتهای ژل مقایسه خوبی برای بررسی جریان در کل عرض ژل میباشد.
چنین به نظر میرسد که برای اهداف تجاری، دستکاری DNA در جهت تولید قطعات لدر DNA محرمانه میباشد. به طور معمول، یک قطعه DNA که شامل واحدهای تکرار پشت سر هم میباشد، طی واکنش هضم آنزیمی از سایتهای برشی توسط آنزیم محدود کننده بریده شده و در یک پلاسمید کلون شده است. سپس در اثر واکنش هضم ناقص آنزیمی لدری با مولتیمرهای تکراری تولید شده است.
انواع لدرهای مورد استفاده در زیست شناسی کدامند ؟
نشانگرهای وزن مولکولی DNA
تکنیک های توسعه در طول سالها جهت تولید لدرها متفاوت بوده است.
یک مشکل اولیه در توسعه نشانگرها، دستیابی به وضوح بالا در تمام طول نشانگر بود. بسته به شرایط اجرای الکتروفورز ژل، قطعات ممکن است فشرده شده باشند و شفافیت را مختل کنند. برای رسیدگی به این مشکل، کیتی برای آنالیز ساترن بلات در سال 1990 ساخته شد که اولین نشانگر را برای ترکیب DNA هدف و DNA پروب ارائه کرد. این تکنیک از فاصله لگاریتمی بهره می برد و برای شناسایی باندهای هدف با طول بیش از 20000 نوکلئوتید میتواند استفاده شود.
روش دوم استفاده از آنزیم های محدود کننده و یک توالی DNA شناخته شده است. DNA توسط یک آنزیم محدود کننده خاص هضم می شود و در نتیجه قطعات DNA با جرم های مولکولی متفاوت ایجاد می شود. یکی از مزایای این روش این است که نشانگر بیشتری را می توان به سادگی با هضم بیشتر DNA شناخته شده به راحتی ایجاد کرد. از سوی دیگر، اندازه قطعات DNA بر اساس مکان هایی است که آنزیم محدود کننده برش می دهد. این امر کنترل اندازه قطعات در نشانگر را دشوارتر می کند.
اثرات شرایط ژل
مانند نمونههای آزمایشی، شرایط ژل میتواند بر اندازه وزن مولکولی لدر تأثیر بگذارد. عواملی مانند بافر، شارژ/ولتاژ و غلظت ژل می توانند بر تحرک و/یا ظاهر لدر شما تأثیر گذار باشد. این عناصر باید هنگام انتخاب یک نشانگر و هنگام تجزیه و تحلیل نتایج نهایی روی ژل در نظر گرفته شوند.
بافرها
- PH را ایجاد می کنند
- یون هایی را برای پشتیبانی از رسانایی فراهم می کنند.
در الکتروفورز DNA، TAE (Tris-acetate-EDTA) و TBE (Tris-borate-EDTA) بافرهای معمول انتخابی هستند. بافر TBE برای قطعات کوچک DNA ترجیح داده می شود، در حالی که TAE برای قطعات بیشتر از 1500 جفت باز مناسب تر است. از نظر ظرفیت بافر، TAE در مقایسه با TBE دارای ظرفیت کمتری است. این به طور کلی منجر به حرکت کندتر DNA می شود. TBE همچنین قادر به وضوح بهتر است.
لازم به ذکر است که آب نمی تواند به عنوان جایگزینی برای یکی از این بافرها عمل کند، زیرا DNA در طول ژل مهاجرت نمی کند. علاوه بر این، استفاده از آب به جای بافر باعث ذوب شدن ژل می شود.
شارژ / ولتاژ
از نظر ولتاژ، محدوده توصیه شده بین 4 تا 10 ولت بر سانتی متر (یعنی ولت در سانتی متر) است. ژل های آگارز معمولاً با ولتاژ V/cm 5کار می کنند. واحد فاصله، سانتی متر، به فاصله بین الکترودها (یعنی آند و کاتد) اشاره دارد و نه طول خود ژل.
ولتاژهای بسیار پایین یا بالاتر از این محدوده بر تحرک و وضوح باندها تأثیر می گذارد. ولتاژهای پایین باعث کاهش تحرک و افزایش باندها می شود. از طرف دیگر، ولتاژهای بالا وضوح باندها را کاهش می دهد. این تا حد زیادی به این دلیل است که ولتاژهای بیش از حد بالا می توانند باعث گرم شدن بیش از حد ژل و حتی ذوب شدن آن شوند.
هنگام انتخاب نشانگر باید غلظت آگارز در نظر گرفته شود. درصد ژل بر مهاجرت DNA تأثیر می گذارد. به طور کلی، هر چه غلظت ژل بیشتر باشد، سرعت حرکت DNA در ژل کندتر است. این علاوه بر نقشی است که وزن مولکولی در مهاجرت نشانگر یا نمونه DNA ایفا می کند، یعنی هر چه وزن مولکولی بالاتر باشد، DNA کندتر حرکت می کند. غلظت ژل همچنین بر توانایی تجسم باندهای روی ژل تأثیر می گذارد. باندهای کوچکتر در ژل با درصد بالاتر بهتر حل می شوند، در حالی که باندهای با وزن مولکولی افزایش یافته در ژل با درصد کمتر به راحتی قابل مشاهده هستند.
نشانگرها و لدرهای RNA
نشانگرهای RNA از رونوشتهای RNA با طولهای افزایشی مختلف تشکیل شده اند. به عنوان مثال، نشانگر Lonza 0.5-9 kbp دارای باندهایی با جفتهای 0.5، 1، 1.5، 2، 2.5، 3، 4، 5، 6 و 9 کیلوبایت است. نشانگرها در یک بافر ذخیره سازی مانند EDTA حل می شوند و در صورت نگهداری در دمای 80- درجه سانتی گراد می توانند تا 2 سال ماندگاری داشته باشند. برای استفاده از نشانگر، مانند آنالیز نوترن بلات، ابتدا ذوب شده و سپس رنگ آمیزی می شود تا در الکتروفورز ژل قابل تشخیص باشد. یکی از رایج ترین رنگ های مورد استفاده برای نشانگرها اتیدیوم بروماید است. محدوده یک نشانگر خاص به انواع باندهایی که می تواند نقشه برداری کند اشاره دارد. محدوده “بالا” به قطعات نسبتا بزرگ (اندازه گیری شده در کیلوبایت) اشاره دارد در حالی که محدوده “پایین” به نشانگرهایی اشاره دارد که بین قطعات کوچک (اندازه گیری شده درbp) تمایز قائل می شوند. حتی برخی از نشانگرها را می توان به عنوان “کم محدوده ” توصیف کرد که حتی دقیق تر از نشانگر microRNA است. یک نشانگر microRNA را می توان برای اندازه گیری قطعات RNA در ده ها نوکلئوتید، مانند نشانگر microRNA 17-25 nt استفاده کرد. در وزن های مولکولی معادل، RNA سریعتر از DNA مهاجرت می کند. نمونه هایی با وزن کمتر می توانند مسافت بیشتری را طی کنند. این رابطه هنگام انتخاب نشانگرهای RNA یا DNA به عنوان استاندارد مورد توجه قرار می گیرد. هنگام بارگذاری نشانگرهای RNA و نمونههای RNA روی ژل، جلوگیری از آلودگی نوکلئاز مهم است، زیرا RNA به تجزیه ریبونوکلئاز (RNase ) از طریق کاتالیز بسیار حساس است. بنابراین، تمام مواد مورد استفاده در روش باید در نظر گرفته شود. هر ظروف شیشه ای که قرار است با RNA تماس پیدا کند باید با دی اتیل پیروکربنات (DEPC) از پیش تیمار شود و مواد پلاستیکی باید یکبار مصرف باشند.
مارکر یا لدر پروتئین

پیش از این، نشانگرهای پروتئینی با استفاده از انواع پروتئین های کامل ساخته شده بودند. توسعه یک کیت شامل نشانگر اندازه وزن مولکولی بر اساس قطعات پروتئینی در سال 1993 آغاز شد. این نشانگر پروتئینی، متشکل از 49 توالی اسید آمینه مختلف، شامل پروتئینهای چند دامنه ای بود و امکان تجزیه و تحلیل پروتئین های شکافته شده در مکان های مختلف را فراهم کرد. بهبود تکنیک فعلی در نشانگرهای پروتئینی شامل استفاده از توسعه خودکار است. اولین نشانگر پروتئینی با وزن منظم که به طور خودکار توسعه یافته بود در سال 2012 اختراع شد.
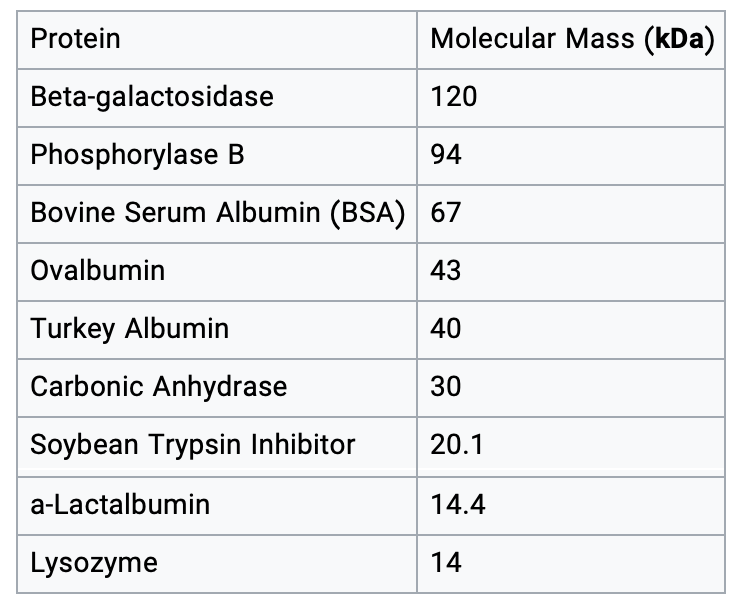
مشابه نشانگرهای DNA، این نشانگرها معمولاً از پروتئین های خالص شده تشکیل شده اند که جرم مولکولی آنها قبلاً شناخته شده است. فهرست زیر برخی از پروتئینها و همچنین جرم مولکولی را که معمولاً هنگام ساخت نشانگر پروتئین استفاده میشوند، نشان میدهد.
Ladder
انتخاب نشانگر پروتئین مناسب
نشانگرهای با وزن مولکولی را می توان به دو دسته تقسیم کرد: نشانگرهای وزن مولکولی در مقابل نشانگرهای لدر مولکولی.
نشانگرها یا رنگ دار هستند یا بدون رنگ، و بسته به شرایط، ممکن است یکی از دیگری مناسب تر باشد. نشانگرهای وزن مولکولی نیز می توانند از نظر بیوشیمیایی تغییر کنند. ترکیب با بیوتین رایج ترین است. نشانگرهای اندازه مولکولی معمولاً در الکتروفورز ژل -SDSپلی آکریل آمید و وسترن بلات استفاده می شوند.
یکی از رایج ترین کاربردهای نشانگرهای اندازه مولکولی در الکتروفورز ژل است. هدف از الکتروفورز ژل جداسازی پروتئین ها بر اساس خواص فیزیکی یا شیمیایی است که شامل بار، اندازه مولکولی و pH می شود. هنگام جداسازی بر اساس اندازه، روش ایده آل SDS-PAGE یا الکتروفورز ژل پلی آکریل آمید است و نشانگرهای اندازه مولکولی وزن مولکولی هستند.
ژل ها می توانند از نظر اندازه متفاوت باشند. تعداد نمونه هایی که باید بارگذاری شوند، اندازه ژل مناسب را تعیین میکند. همه ژل ها به خطوطی تقسیم می شوند که به موازات ژل می گذرند. هر خط شامل یک نمونه خاص خواهد بود. به طور معمول، استانداردهای اندازه مولکولی در یک خط بیرونی قرار می گیرند. اگر یک ژل دارای تعداد خطوط مخصوصاً بالایی باشد، ممکن است برای شفافیت بیشتر لدر های متعددی در سراسر ژل قرار داده شود.
پروتئین ها و استانداردها در خطوط مناسب روی ژل پیپت می شوند. سدیم دودسیل سولفات SDS) ) با پروتئینها تعامل می کند، آنها را دناتوره می کند و به آنها بار منفی می دهد. از آنجایی که همه پروتئین ها نسبت بار به جرم یکسان دارند، تحرک پروتئین از طریق ژل صرفاً بر اساس وزن مولکولی خواهد بود. هنگامی که میدان الکتریکی روشن می شود، مهاجرت پروتئین آغاز می شود. پس از تکمیل، می توان از مکانیزم تشخیصی مانند وسترن بلات استفاده کرد که حضور باندها را آشکار می کند. هر باند نشان دهنده یک پروتئین خاص است. فاصله جابهجایی صرفاً بر اساس وزن مولکولی است. بنابراین، وزن مولکولی هر پروتئین را می توان با مقایسه فاصله یک پروتئین ناشناخته با استاندارد وزن مولکولی شناخته شده تعیین کرد.
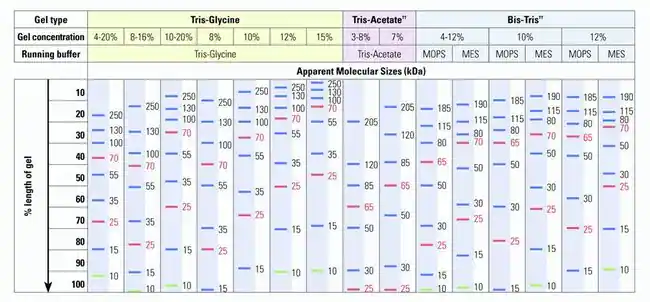
اثرات شرایط ژل
همانند الکتروفورز DNA، شرایطی مانند بافرها، بار/ولتاژ و غلظت باید هنگام انتخاب نشانگر پروتئین در نظر گرفته شوند.
بافرها
بافرها می توانند هم بر تحرک نشانگر و هم بر تحرک نمونه ها تأثیر بگذارند. pH بافر بسته به سیستم مورد استفاده متفاوت است و در نتیجه هر سیستم بافر اثر متفاوتی از بار پروتئین یا پروتئین خواهد داشت. علاوه بر این، در مورد SDS-PAGE، میل اتصال برای SDS می تواند تحت تأثیر سیستم بافر قرار گیرد. حتی هنگام استفاده از درصد و نوع ژل یکسان، پروتئین های مشابه بسته به بافر مورد استفاده با سرعت های متفاوتی مهاجرت می کنند.
شارژ / ولتاژ
ولتاژ در تحرک پروتئین ها روی ژل نقش دارد. پروتئین ها در ولتاژهای بالاتر سریعتر مهاجرت می کنند. در نتیجه زمان اجرای ژل کوتاه تر خواهد بود. برعکس، ولتاژهای بالاتر می تواند منجر به انتشار بیشتر باند شود. همچنین، اگر ولتاژ بیش از حد بالا باشد، دما در محفظه الکتروفورز می تواند به حدی برسد که ژل شروع به ذوب شدن کند.
ولتاژی که ژل باید با آن کار کند به نوع ژل بستگی دارد. برای برخی از ژلها، ولتاژ در طول کار ثابت میماند، در حالی که در مورد ژلهای دیگر، ولتاژ اولیه قبل از افزایش مدت زمان مشخصی ثابت میماند. این ولتاژ دوم سپس برای یک بازه زمانی خاص استفاده می شود، پس از آن، ممکن است آن را نیز افزایش دهد.
از نظر درصد، ژل های مورد استفاده برای الکتروفورز پروتئین را می توان به ژل های تک درصدی و ژل های گرادیان تقسیم کرد. به ژل های تک درصدی ژل خطی نیز گفته می شود. برای ژل های خطی، درصد انتخاب شده معمولاً بین 7.5٪ تا 20٪ است. محدوده درصد رایج برای ژل های گرادیان 4-15٪ و 10-20٪ است. هر نوع ژل مزایای خاص خود را دارد. به عنوان مثال، ژل های خطی زمانی ترجیح داده می شوند که چندین پروتئین دارای وزن مولکولی مشابه باشند. جداسازی بهتر بین این پروتئین ها توسط یک ژل خطی نمایش داده می شود. از سوی دیگر، ژلهای گرادیان زمانی انتخاب بهتری هستند که نمونههای مورد نظر حاوی پروتئینهایی با وزنهای مولکولی بسیار متفاوت باشند یا طیف وسیعی از وزنهای مولکولی را پوشش دهند.
چه تفاوتی بین لدرها و مارکرها وجود دارد ؟
اصطلاح “لدر” به دلیل ظاهر نشانگر DNA روی ژل ها به صورت نام تجاری انتخاب شده است. باندها شبیه پلههای یک لدر (ladder) هستند. نشانگر یا لدرمجموعه ای از قطعات DNA است و طول جفت باز هر قطعه مشخص است. این یک استاندارد در نظر گرفته می شود زیرا می تواند به عنوان ابزاری برای اندازه گیری طول قطعات DNA ناشناخته استفاده شود.
نشانگر DNA به معنای دنباله ای از DNA است که برای علامت گذاری یک مکان خاص در یک کروموزوم خاص استفاده می شود در حالی که لدر DNA فقط قطعه DNA با اندازه خاص است و می تواند از هر منبع DNA باشد.
چه تفاوتی بین لدرهای DNA وپروتئین وجود دارد ؟
در بیولوژی مولکولی ، خط کش ها و نشانگرها برای تفسیر نتیجه تحقیق بسیار مهم هستند. بدون آنها، جداسازی DNA یا پروتئین ها از طریق الکتروفورز ژل یا به عنوان مثال SDS-PAGE را نمی تواند صورت گیرد. دانشمندان یک خط اضافی را با نشانگر وزن مولکولی بارگذاری میکنند. این بارگذاری شامل چندین مقدار معین DNA یا پروتئین در محدوده موضوع تحقیق است. باندهای جدا شده با هم مانند یک لدر روی ژل به نظر می رسند بنابراین پروتئین یا لدر DNA نامیده میشوند. با مقایسه باندهای نمونه با لدر می توان طول را تفسیر کرد. اگرچه لدر ها برای استفاده در تجزیه و تحلیل کمی در نظر گرفته نشده اند، اما می توان مقدار تقریبی از مقدار هدف آزمایشی را از شدت نسبی نمونه و باندی که در نشانگر وزن مولکولی که از نظر اندازه و مقدار (محاسبه شده) مشابه است را نشان میدهد، به دست آورد.
از آنجایی که پروتئین ها و اسیدهای نوکلئیک عمدتاً بی رنگ هستند، حرکت آنها از طریق ژل در طول الکتروفورز به راحتی قابل پیگیری نیست. بنابراین معمولاً رنگهای آنیونی با تحرک الکتروفورتیک شناخته شده در بافر نمونه استفاده میشوند. از آنجایی که این مولکولها بسیار متحرک هستند، جلوتر از اکثر پروتئین ها / DNA حرکت می کنند. با رسیدن به انتهای آندی محیط الکتروفورز، الکتروفورز متوقف می شود. رنگهای ردیابی رایج عبارتند از زایلن سیانول، کرزول قرمز، بروموفنول آبی، نارنجی جی یا تارترازین بوده که تحرک آنها کمی متفاوت است.
برای تجسم باندهای DNA، اتیدیوم بروماید به دلیل قیمت پایین و به طور کلی حساسیت کافی، رنگ غالب برای رنگ آمیزی اسید نوکلئیک برای چندین دهه مورد استفاده بوده است. با این حال، چندین اشکال اتیدیوم بروماید شناخته شده است، از جمله اینکه اتیدیوم بروماید یک جهشزا/سرطانزا است و خطر بالایی برای ایجاد سرطان دارد. علاوه بر این، نور فرابنفش (UV) مورد استفاده برای روشن کردن ترکیبات EtBr-DNA احتمالاً در صورت عدم هدایت نادرست منجر به آسیب پوست یا چشم کاربر می شود. همچنین اشاره شده است که قرار گرفتن در معرض نور UV ممکن است باعث تغییرات شیمیایی نمونههای DNA در ژل شود، مانند تشکیل دایمرهای TT، که منجر به چالشهایی با دستکاریهای بعدی DNA میشود.
به همین دلیل، رنگهای ژل DNA جایگزین اتیدیوم بروماید، مانند رنگهای SYBR®، GelRed™ و GelGreen™ یا Novel Green در سالهای اخیر به صورت تجاری در دسترس قرار گرفتهاند. اگرچه این رنگهای جایگزین رنگآمیزی اسید نوکلئیک، جهشزایی را کاهش دادهاند، اما گاهی اوقات باید جنبههای دیگر رنگها را قربانی کنند. محلول انبار DMSO، که بیشتر آنها در آن حل می شوند، باید با احتیاط خاصی استفاده شود زیرا DMSO ورود مولکول های آلی به بافت ها را تسهیل میکند.
لدرهای پروتئینی برای کاربردهای مختلفی مانند نظارت بر پروتئین جدا شده در طول الکتروفورز ژل SDS-پلی آکریل آمید، تأیید کارایی انتقال در وسترن بلات بر روی غشاها (PVDF، نایلون یا نیتروسلولز) یا اندازه تقریبی پروتئین ها؛ طراحی شده اند. برای قابل مشاهده شدن پروتئینها، باید یک واکنش شیمیایی خاص پروتئین، اتصال دهنده یا تولید رنگ روی پروتئینهای داخل ژل انجام شود. رایج ترین آنها رنگ آمیزی با کوماسی بلو و نیترات نقره میباشد.
لدر ۵۰ بازی چیست و چه کاربردی دارد ؟
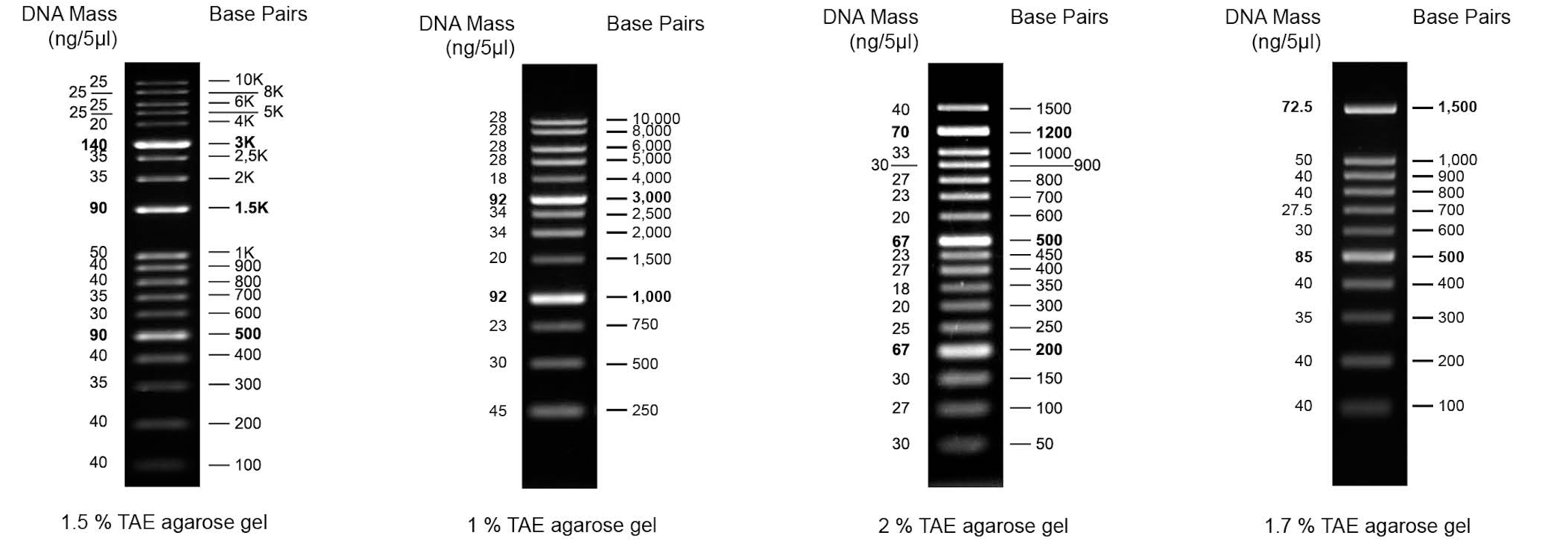
معمولا لدر DNA 50 جفت باز برای اندازه گیری و تعیین کمیت تقریبی DNA دو رشته ای در محدوده 50 جفت باز تا 2500 جفت باز طراحی شده است. معمولا لدر DNA 50 جفت باز از 17 قطعه DNA خالص شده با کروماتوگرافی مجزا تشکیل شده است و دارای باندهای مرجع در 2500، 800 و 350 جفت باز برای جهت گیری آسان است. تعدادی از پلاسمیدهای اختصاصی با آنزیمهای محدودکننده مناسب هضم میشوند تا 17 باند مناسب برای استفاده به عنوان استاندارد وزن مولکولی برای الکتروفورز ژل آگارز و پلی آکریل آمید تولید شود. DNA هضم شده شامل قطعاتی از 50 تا 1350 جفت باز است. باندهای 200 و 500 جفت پایه شدت را افزایش داده اند تا به عنوان نقاط مرجع عمل کنند.
لدر ۱۰۰ بازی چیست و چه کاربردی دارد ؟
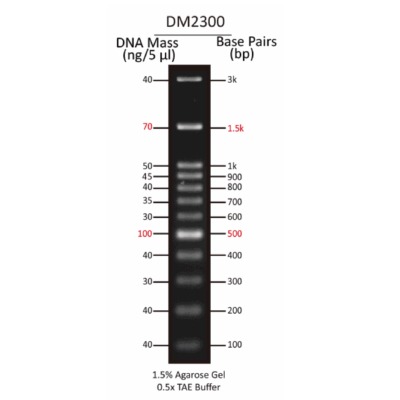
لدر 100bp یک استاندارد برای اندازه گیری سایز DNA است که برای اندازه و کمی کردن DNA دو رشته ای با اندازه در محدوده 100 جفت باز تا 1500 جفت باز استفاده می شود. این لدرها از حدود 11 قطعه DNA بسیار خالص تشکیل شده اند که باندهای شفاف جداگانهای را برای شناسایی سایر قطعات DNA در آن محدوده تشکیل می دهند. 11 باند در این محصول عبارتند از: 100bp,200bp,300bp,400bp,500bp,600bp,700bp,800bp,900bp,1000bp,1500bp,.
لدر ۱۰۰۰ بازی چیست و چه کاربردی دارد ؟
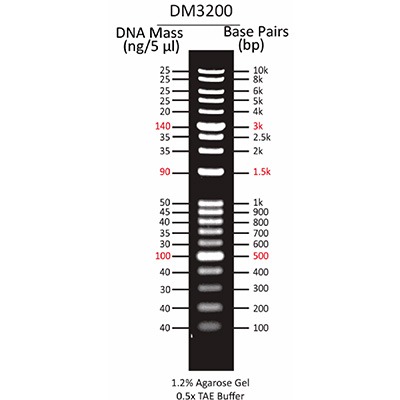
لدر DNA 1000 bp/1 kb برای تعیین کمیت دقیق و کمی جرم DNA طراحی شده است. هیچ باند نامشخصی به جز قطعات وجود ندارد. قطعه 500 جفت باز، 1000 جفت باز و 3000 جفت باز به عنوان باند مرجع استفاده می شود. لدر DNA 1kb امکان تعیین اندازه DNA دو رشته ای را از 250 تا 10000 جفت باز میدهد. این لدر از 13 قطعه دو رشتهای و با انتهای بلانت در اندازه های 250، 500، 750، 1000، 1500، 2000، 2500، 3000، 4000، 5000، 6000، و 8000 تشکیل شده است.
کیلو دالتون در لدرهای پروتئینی به چه معناست ؟
اندازه پروتئین بر حسب دالتون اندازه گیری می شود که اندازه گیری وزن مولکولی است. یک دالتون به عنوان جرم یک اتم هیدروژن تعریف می شود که گرم است. بیشتر پروتئین ها جرم هایی در حدود هزاران دالتون دارند، بنابراین اصطلاح کیلودالتون (kD) اغلب برای توصیف وزن مولکولی پروتئین استفاده می شود. بنابراین یک پپتید با جرم 64 کیلو دالتون دارای وزن مولکولی 64000 گرم بر مول است.
یک لدر خوب چه ویژگی هایی باید داشته باشد ؟
بدون لدر، تجزیه و تحلیل دقیق نمونه ها ممکن نخواهد بود. لدرها حاوی قطعات استاندارد هستند. از آنجایی که وزن مولکولی آنها مشخص است، محققان میتوانند به سرعت نمونههای خود را با لدر در همان ژل مقایسه کنند تا وزن مولکولی تقریبی نمونه خود را تعیین کنند، یا مشخص کنند کدام یک از باندها نمونهی مورد نظر درون ژل است.
انتخاب یک لدر بسیار چالش برانگیز نیست، اما با گزینههای زیاد و ویژگیهای مختلف، پیدا کردن آنچه میخواهید میتواند کمی زمان ببرد.
محدوده اندازه
مهمترین عامل در انتخاب یک لدر، اندازه مورد انتظار باندها در آزمایش شما است. شما می خواهید مطمئن شوید که محدوده لدر، از کوچکترین تا بزرگترین قطعه آن، شامل اندازه مورد انتظار قطعاتی است که آزمایش می کنید.
تعداد باندها در محدوده اندازه معین
نکته مهم دیگر تعداد باندهای لدر در محدوده اندازه معین است. استفاده از لدر با باندهای بیشتر در یک محدوده مشخص، تخمین دقیق اندازه قطعات را در نمونه آسان تر می کند. با این حال، مسئله این است که برای تفسیر واضح لدر با باندهای بیشتر، باید زمان عبور جریان در ژل را طولانیتر کرد. اگر دانستن اندازه دقیق یک باند مهم است، لدری با باندهای بیشتری انتخاب کرده و مدت عبور جریان از ژل را طولانیتر میکنیم. اگر زمان محدود است، یا تخمین تقریبی اندازه باند کافی است، لدری انتخاب کرده که باندهای زیادی نداشته باشد.در پایان، دانشمندان بسته به نیازهای هر آزمایش خاص، از طیف گسترده ای از لدرهای مختلف انتخاب می کنند. این به ترجیحات شخصی نیز برمی گردد. مثلاً می توان چند لدر مختلف را آزمایش کرد و سپس مناسبترین با توجه به شرایط را انتخاب کرد.
تفاوت لدرهای ۵۰ بازی و ۱۰۰ بازی و ۱۰۰۰ بازی چیست ؟
50 جفت باز: 17 قطعه بین 50 جفت باز تا 1500 جفت باز ونقاط مرجع (باندهای شدید) در 200 جفت باز و 500 جفت باز.
100 جفت باز: 11 قطعه بین 100 جفت باز تا 1500 جفت باز و نقاط مرجع در جفت پایه 500 و 1500.
1 کیلوبایت: 13 قطعه با گستره بین 250 تا 10000 جفت باز ونقاط مرجع در 1 کیلوبایت و 3 کیلوبایت.